[서울파이낸스 김현경 기자] 미국 제약사 모더나가 개발한 코로나19 백신이 국내 자문과정의 두번째 관문을 통과해 품목허가에 다가섰다다. 13일 식품의약품안전처는 법정 자문기구인 중앙약사심의위원회에서 모더나 코비드-19백신주의 안전성과 효과성을 논의한 결과 품목허가가 가능하다고 의견을 모았다고 밝혔다.
식약처는 코로나19 백신과 치료제의 경우 객관적이고 투명한 허가 및 심사를 위해 코로나19 백신·치료제 안전성·효과성 검증자문단, 중앙약사심의위원회, 최종점검위원회로 이어지는 외부 전문가의 3중 자문 절차를 밟고 있다. 이날 중앙약심에는 감염병 전문가와 바이러스학 및 약학 전문가 14명과 식약처 내부 코로나19 위기대응 지원본부 백신심사반의 총괄검토팀, 임상심사팀, 품질심사팀 8명이 참여했다.
전문가들이 모더나 백신의 임상 3상 시험 자료를 분석한 결과, 18세 이상에 2회 투여 14일 후 예방효과가 94.1%로 허가 가능한 수준이라고 판단했다. 임상시험에서 발생한 이상 사례는 허용할 수 있는 수준이어서 안전에 큰 문제는 없다고 봤다. 단 허가 후 전반적인 안전성 확보를 위해 위해성관리계획이 필요하다는 의견을 냈다.
백신 투여와 관련성을 배제할 수 없는 중대한 이상반응은 얼굴이 부어오르는 얼굴 종창 2건을 비롯한 총 9건이었으나 임상시험 자료를 제출하는 시점에는 대부분 회복 중이었다. 얼굴 종창은 미용성형시술인 필러 시술 이력이 있는 사람에게 나타나 식약처는 이 부분을 사용상의 주의사항에 기재하고 면밀히 관찰할 예정이다.
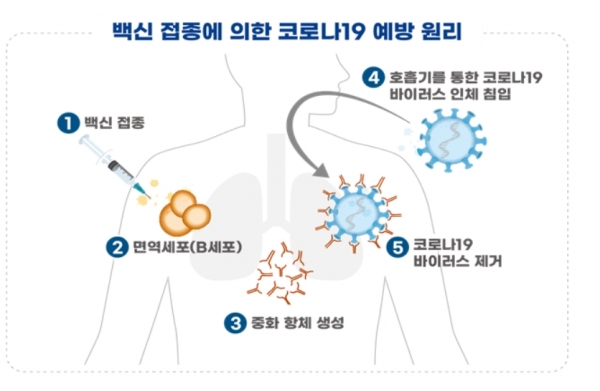
식약처는 검증 자문단과 이번 중앙약심 자문을 통해 얻은 전문가 의견과 효능·효과, 용법·용량, 권고사항을 종합한 후 최종점검위원회를 개최해 허가 여부를 결정하기로 했다. 최종점검위원회는 오는 21일 열릴 예정이다.
모더나 백신은 메신저 리보핵산(mRNA, 전령RNA) 플랫폼으로 개발된 제품으로, 1바이알(약병) 당 10명에 접종할 수 있다. 국내에서 허가된 화이자의 코로나19 백신 코미나티주와 동일한 플랫폼으로 개발됐다. 이 제품은 미국과 영국에서 긴급사용을 승인했고 유럽연합(EU)과 캐나다, 스위스에서 허가 후 자료를 추가로 제출하도록 조건부 허가했다.
국내에서는 GC녹십자가 모더나 코로나19 백신의 허가와 유통을 맡고 있다. GC녹십자는 지난 2월 말 조달청 입찰에서 질병관리청이 공고한 모더나 백신의 국내 허가 및 유통 담당 사업자로 선정된 바 있다. 이번에 식약처가 품목허가 심사를 하는 모더나 백신의 경우 원액은 스위스에서, 완제품은 스페인에서 제조되는 제품이다.
- 삼성바이오로직스 "화이자 백신 위탁생산 안해"···주가는 4.77%↑
- 코백스 AZ백신 83만5천회분 내일 도착
- "모더나 백신 94.1% 효과"···국내 1차관문 통과
- 휴마시스, 코로나19 신속 항체진단키트 식약처 허가
- 김강립 식약처장, 아스트라제네카 백신 접종
- 식약처, GC녹십자 코로나19 혈장치료제 심사착수
- HK이노엔, 코로나19 백신 후보물질 임상1상 신청
- 셀트리온, 코로나19 중화항체 진단키트 유럽 인증
- "3분기까지 노바백스 2천만 회분"···文 "신속 허가 협력" (종합)
- 식약처 "LDS주사기 이물 신고 4건···인체 혼입 없어"
- 한미약품, 제넥신 코로나19 백신 위탁생산
- 식약처, 모더나 백신 허가···4000만회분 구매계약











![[광명소식] 보건복지부 '그냥드림' 시범사업장 선정 등](https://cdn.seoulfn.com/news/thumbnail/custom/20251126/613704_413206_721_1764122841_220.jpg)
