글자크기 설정
기사의 본문 내용은 이 글자크기로 변경됩니다.
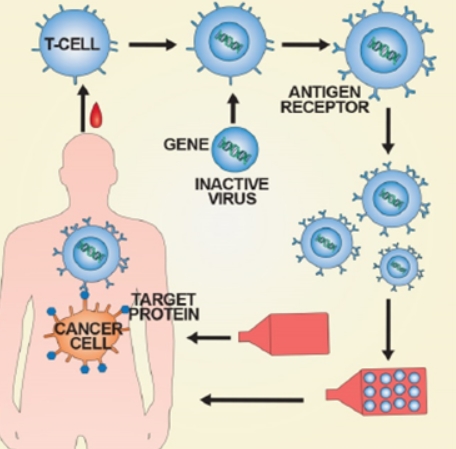
[서울파이낸스 김현경 기자] 식품의약품안전처는 노바티스의 키메라 항원 수용체 T세포(CAR-T·카티) 치료제 킴리아주(티사젠렉류셀)를 제1호 첨단바이오의약품으로 허가했다고 5일 밝혔다. 이 약은 재발성·불응성인 25세 이하 B세포 급성 림프구성 백혈병 환자, 미만성 거대 B세포 림프종 성인환자 치료에 쓰인다.
카티세포는 면역세포인 T세포의 수용체 부위와 암세포 표면의 특징적인 항원 인식 부위를 융합한 유전자를 환자의 T세포에 도입한 것이다. 암세포의 표면 항원을 특이적으로 인지해 공격하는 기능을 갖는다.
킴리아주는 환자에게서 채취한 면역 T세포 표면에 암세포의 특정 항원을 인지할 수 있도록 유전정보를 도입한 후 환자의 몸에 주입하는 방식의 항암제다. 미국에서는 획기적 의약품(Breakthrough designation), 유럽에서는 우선순위의약품(PRIME)으로 각각 지정된 후 허가받았다.
이 약은 첨단재생바이오법에 따른 장기 추적 조사 대상 의약품이다. 이상사례 현황에 대해 투여일로부터 15년간 장기 추적해야 하며, 최초 판매한 날부터 1년마다 장기 추적 조사한 내용과 결과를 식약처에 보고해야 한다.
이 기사를 공유합니다
관련기사
- [업무보고] 식약처, 코로나19 백신 안전 검증 철저···냉장유통 전단계 추적
- 대유행감염병·희소병 치료할 첨단바이오의약품 '신속 허가'
- 식약처, 내년 예산안 6044억···코로나19 지원·급식관리 강화
- 첨단바이오법 시행령 의결···관련 의약품 제조 관리 강화
- 줄기세포·유전자치료제 투여자 '장기추적' 조사 의무화
- 첨단재생바이오법 시행령 입법예고
- 식약처 "신약개발 촉진하고 안전관리 강화"
- GC녹십자웰빙, 암악액질 신약 근위축억제 효과 확인
- 삼성바이오에피스, 서울대 약대와 바이오·제약 인재 양성
- 식약처, 노바티스 '졸겐스마주' 첨단바이오의약품 허가
- GC셀, 항-HER2-CAR 호주 특허 취득


![[에너지탄소포럼] 강민구 변호사 "한국 VCM, 지원 중심 입법이 시급"](https://cdn.seoulfn.com/news/thumbnail/custom/20251126/613709_413212_059_1764126061_220.jpg)








![[광명소식] 보건복지부 '그냥드림' 시범사업장 선정 등](https://cdn.seoulfn.com/news/thumbnail/custom/20251126/613704_413206_721_1764122841_220.jpg)
